
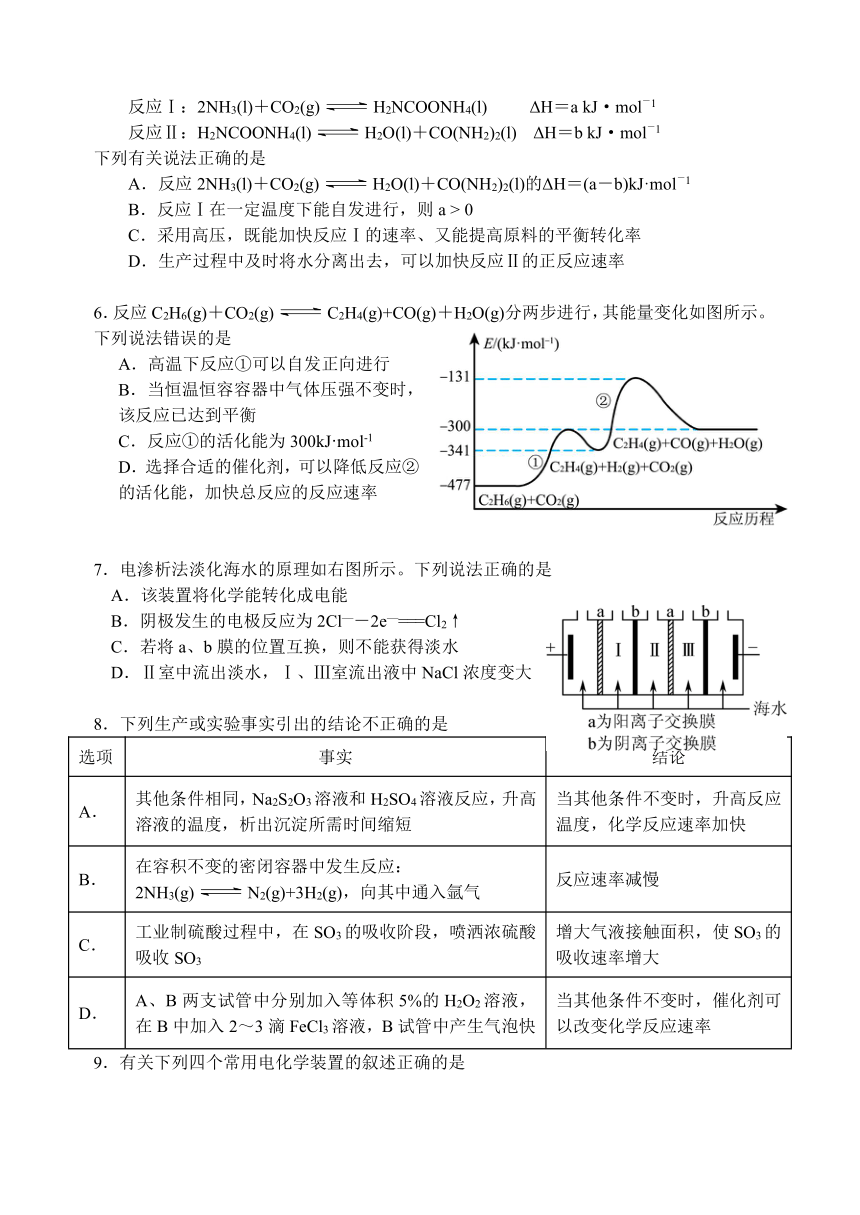
江苏省扬州中学2024-2025学年第一学期阶段检测 高二化学 2024.10 试卷满分:100分 考试时间:75分钟 可能用到的相对原子质量:H-1 O-16 Na-23 Ⅰ卷(选择题,) 选择题:共13题,每题3分,。每小题只有一个选项最符合题意。 1.化学与生产、生活及很多研究领域存在着广泛的联系。下列说法错误的是 A.使用植物秸秆转化的乙醇为燃料,可以减少污染,实现碳的零排放 B.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法 C.研制了高效率钙钛矿太阳能电池,其能量转化形式为:太阳能电能 D.规范使用防腐剂可以减缓食物变质速度,保持食品营养价值 2.下列物质间的反应,其能量变化符合右图的是 A.合成氨反应 B.碳与水蒸气高温制水煤气 C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合反应 D.碳酸钙的分解 3.CO2催化加氢制备CH3OH是CO2资源化利用的重要途径。已知下图所示的反应的能量变化,下列说法正确的是 A.由图1知H2(g)的燃烧热 △H=-120kJ/mol B.由图1推知反应物断键吸收的能量大于生成物成键释放的能量 C.图2中,若生成的H2O为液态,则能量变化曲线为① D.2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1340kJ/mol 4.对于反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,下列有关说法正确的是 A.升高体系温度正反应速率增大,逆反应速率减小 B.若容器体积不变,气体颜色不变时说明该反应建立化学平衡 C.其它条件不变,向平衡后的容器中再加入少量 N2O4,新平衡后 的值变大 D.增大体系的压强能提高 N2O4 的反应速率和平衡转化率 5.工业上利用NH3和CO2制取尿素[CO(NH2)2],有关反应的热化学方程式如下: 反应Ⅰ:2NH3(l)+CO2(g)H2NCOONH4(l) ΔH=a kJ·mol-1 反应Ⅱ:H2NCOONH4(l)H2O(l)+CO(NH2)2(l) ΔH=b kJ·mol-1 下列有关说法正确的是 A.反应2NH3(l)+CO2(g)H2O(l)+CO(NH2)2(l)的ΔH=(a-b)kJ·mol-1 B.反应Ⅰ在一定温度下能自发进行,则a > 0 C.采用高压,既能加快反应Ⅰ的速率、又能提高原料的平衡转化率 D.生产过程中及时将水分离出去,可以加快反应Ⅱ的正反应速率 6.反应C2H6(g)+CO2(g)C2H4(g)+CO(g)+H2O(g)分两步进行,其能量变化如图所示。下列说法错误的是 A.高温下反应①可以自发正向进行 B.当恒温恒容容器中气体压强不变时,该反应已达到平衡 C.反应①的活化能为300kJ·mol-1 D.选择合适的催化剂,可以降低反应②的活化能,加快总反应的反应速率 7.电渗析法淡化海水的原理如右图所示。下列说法正确的是 A.该装置将化学能转化成电能 B.阴极发生的电极反应为2Cl—-2e—===Cl2↑ C.若将a、b膜的位置互换,则不能获得淡水 D.Ⅱ室中流出淡水,Ⅰ、Ⅲ室流出液中NaCl浓度变大 8.下列生产或实验事实引出的结论不正确的是 选项 事实 结论 A. 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出沉淀所需时间缩短 当其他条件不变时,升高反应温度,化学反应速率加快 B. 在容积不变的密闭容器中发生反应: 2NH3(g)N2(g)+3H2(g),向其中通入氩气 反应速率减慢 C. 工业制硫酸过程中,在SO3的吸收阶段,喷洒浓硫酸吸收SO3 增大气液接触面积,使SO3的吸收速率增大 D. A、B两支试管中分别加入等体积5%的H2O2溶液,在B中加入2~3滴FeCl3溶液,B试管中产生气泡快 当其他条件不变时,催化剂可以改变化学反应速率 9.有关下列四个常用电化学装置的叙述正确的是 图Ⅰ所示电池中,MnO2的作用是做催化剂 图Ⅱ所示电池放电过程中,正极电极反应式:PbO2-2e-+SO42-+4H+=PbSO4+2H2O C.图Ⅲ所示装置工作过程中,其正极电池反应式:O2+4e-+4H+=2H2O D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中被氧化为Ag 10.电解原理具有广泛的应用。下列关于图示四个装置的叙述不正确的是 A.装 ... ...
~~ 已预览到文档结尾了 ~~