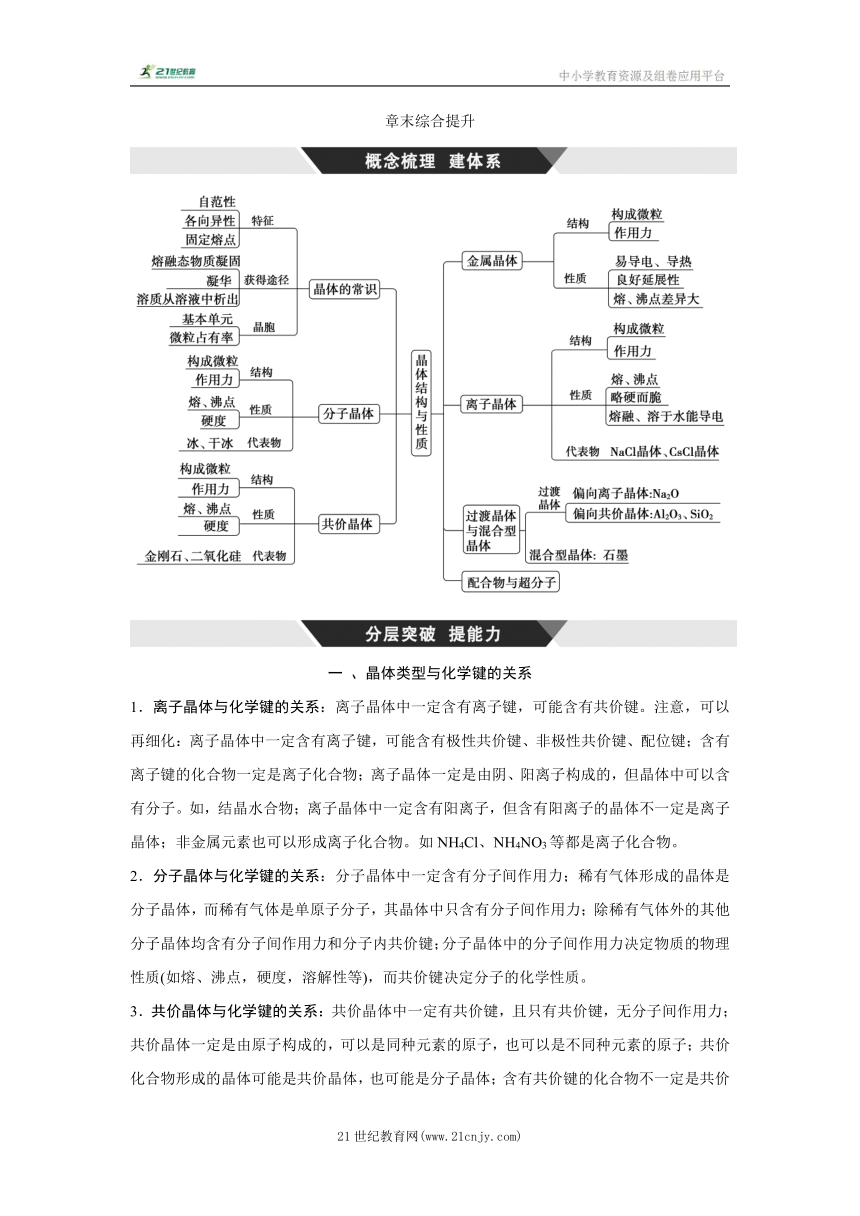

章末综合提升 一 、晶体类型与化学键的关系 1.离子晶体与化学键的关系:离子晶体中一定含有离子键,可能含有共价键。注意,可以再细化:离子晶体中一定含有离子键,可能含有极性共价键、非极性共价键、配位键;含有离子键的化合物一定是离子化合物;离子晶体一定是由阴、阳离子构成的,但晶体中可以含有分子。如,结晶水合物;离子晶体中一定含有阳离子,但含有阳离子的晶体不一定是离子晶体;非金属元素也可以形成离子化合物。如NH4Cl、NH4NO3等都是离子化合物。 2.分子晶体与化学键的关系:分子晶体中一定含有分子间作用力;稀有气体形成的晶体是分子晶体,而稀有气体是单原子分子,其晶体中只含有分子间作用力;除稀有气体外的其他分子晶体均含有分子间作用力和分子内共价键;分子晶体中的分子间作用力决定物质的物理性质(如熔、沸点,硬度,溶解性等),而共价键决定分子的化学性质。 3.共价晶体与化学键的关系:共价晶体中一定有共价键,且只有共价键,无分子间作用力;共价晶体一定是由原子构成的,可以是同种元素的原子,也可以是不同种元素的原子;共价化合物形成的晶体可能是共价晶体,也可能是分子晶体;含有共价键的化合物不一定是共价化合物;共价晶体可以由极性键构成,也可以由非极性键构成。 4.金属晶体与化学键的关系:金属晶体中一定有金属键,但有时也有不同程度的其他键。如,合金中可含有共价键;金属键不一定就比分子间作用力强。如,汞常温下为液态,就说明汞中的金属键很弱;具有金属光泽且能导电的单质不一定就是金属,如石墨能导电,有金属光泽,却属于非金属。 金属晶体和离子晶体是重要的晶体类型。关于它们的说法中正确的是( ) ①金属晶体导电,离子晶体在一定条件下也能导电 ②CsCl晶体中每个Cs+周围有6个Cl- ③金属晶体和离子晶体的熔、沸点都很高 ④金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂因而都具有延展性 A.①② B.① C.①③ D.①④ 答案:B 解析:①金属晶体中含自由电子,能导电而离子晶体只有在溶于水或熔融状态下才能导电,在固态时不导电,①正确;②CsCl晶体中,每个Cs+周围有8个Cl-,②错误;③钠属于金属晶体,但其熔点很低,③错误;④离子键在受到锤打或锻压时会断裂,因而离子晶体没有延展性,④错误;故选B。 对点练1.下列说法中正确的是( ) ①晶体中分子间作用力越大分子越稳定 ②共价晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体形的分子,其晶体类型可能是共价晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中共价键的物质的量为0.8 mol A.①②③④⑤ B.②④⑦ C.②④⑥⑦ D.③④⑤⑥⑦ 答案:B 解析:①分子的稳定性取决于分子内共价键键能的大小,与分子间作用力无关,错误;②共价晶体中共价键越强,破坏它所需的能量越大,熔点越高,正确;③CO2分子间不能形成氢键,错误;④在Na2O和Na2O2晶体中阴离子分别为O2-、O,阳离子都为Na+,阴、阳离子数之比都为1∶2,正确;⑤正四面体形的分子,其晶体类型是分子晶体,错误;⑥稀有气体形成的分子晶体中不含有化学键,错误;⑦4.8 g碳原子的物质的量为0.4 mol,金刚石晶体中平均每个碳原子形成2个共价键,所以共价键的物质的量为0.4 mol×2=0.8 mol,正确。由上述分析可知说法正确的是②④⑦。 对点练2.下列关于分子晶体的说法不正确的是( ) A.分子晶体中含有分子 B.固态或熔融态时均能导电 C.分子间以分子间作用力相结合 D.熔、沸点一般比较低 答案:B 解析:A.分子晶体是由分子构成的,A正确;B.固态或熔融态时,分子晶体既不 ... ...
~~ 已预览到文档结尾了 ~~