
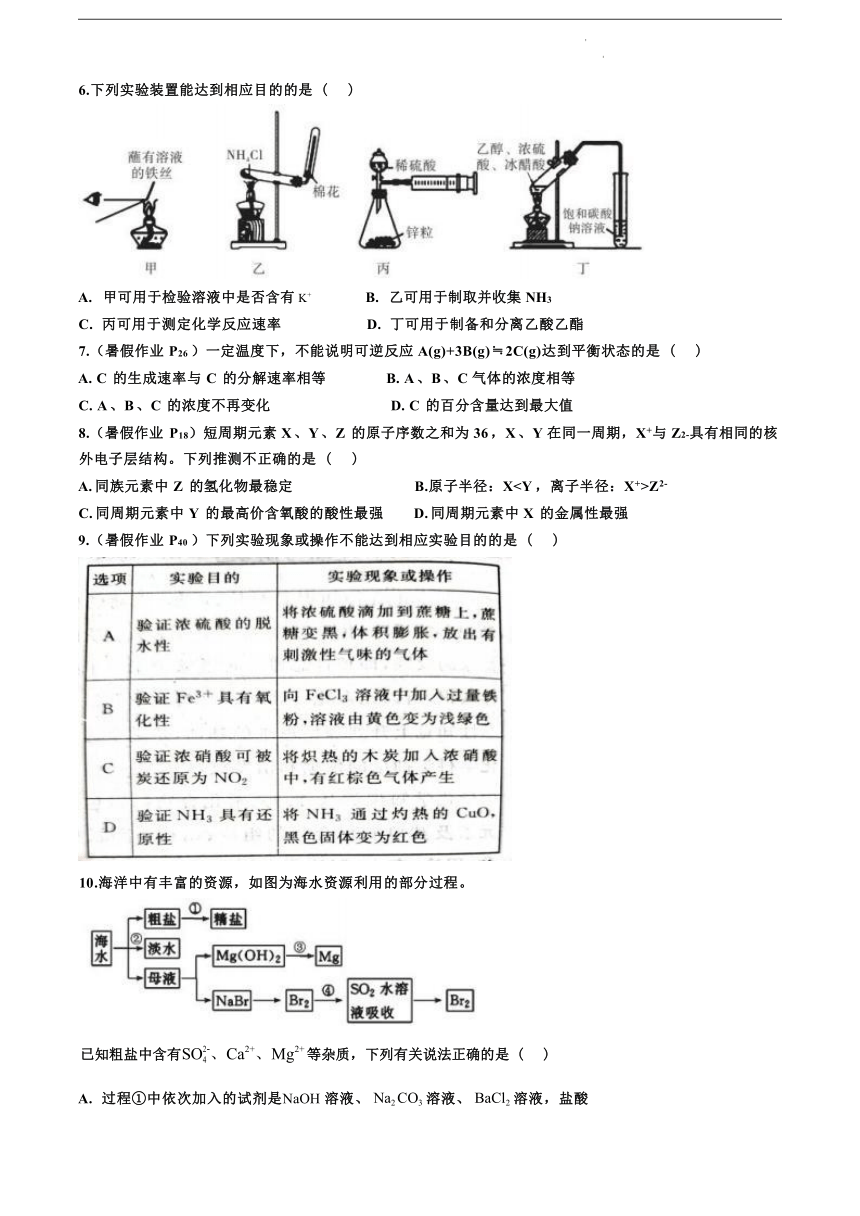
驻马店市树人高级中学 2023 级高二秋季开学考试 化 学 试 题 时间:75 分钟 总分:100 分 可能用到的相对原子质量 H 1 C 12 O 16 一、选择题:(本题共 16 小题,每小题 3 分,共 48 分) 1.(暑假作业 P36 )化学与人类生活、生产和社会可持续发展密切相关。下列说法错误的是 ( ) A.“84”消毒液具有强氧化性,可用于居家环境杀菌消毒 B.酸雨、土壤酸化等环境问题通常都与硫的化合物有关 C.天然气、液化石油气和煤是我国目前推广使用的清洁燃料 D.减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施 2.下列各组离子在溶液中为无色且能大量共存的是 ( ) A.Na+ 、H+ 、Cl- 、ClO- B. Na+ 、Ca2+ 、Cl- 、HCO3- C.Fe2+ 、K+ 、I- 、SO42- D. Ba2+ 、Na+ 、CO32- 、NO3- 3.下列叙述中,正确的是 ( ) A.KNO3 固体不导电,所以 KNO3 不是电解质 B.铜丝、石墨均能导电,所以它们都是电解质 C.熔融的 MgCl2 能导电,所以 MgCl2 是电解质 D.NaCl 溶于水,在通电条件下才能发生电离 4.下列有关化学用语表示正确的是 ( ) A. S2- 的结构示意图: B. 乙醇的结构简式:C2H6O C. CH4 分子的球棍模型: D. 氯化氢分子的电子式: 5.(暑假作业 P41 )设 NA 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.11.2L 二氧化碳气体和 9g 水中所含的分子数均为 0.5NA B.25℃ 、101 kPa 下,22.4L 氧气的分子数为 NA C.常温常压下,16gCH4 中含有 4NA 个 C-H D.0.5 molC2H4 含有 NA 个原子 6.下列实验装置能达到相应目的的是 ( ) A. 甲可用于检验溶液中是否含有 K+ B. 乙可用于制取并收集 NH3 C. 丙可用于测定化学反应速率 D. 丁可用于制备和分离乙酸乙酯 7.(暑假作业 P26 )一定温度下,不能说明可逆反应 A(g)+3B(g)≒2C(g)达到平衡状态的是 ( ) A. C 的生成速率与 C 的分解速率相等 B. A 、B 、C 气体的浓度相等 C. A 、B 、C 的浓度不再变化 D. C 的百分含量达到最大值 8.(暑假作业 P18)短周期元素 X 、Y 、Z 的原子序数之和为 36 ,X 、Y 在同一周期,X+与 Z2-具有相同的核 外电子层结构。下列推测不正确的是 ( ) A. 同族元素中 Z 的氢化物最稳定 B.原子半径:XZ2- C. 同周期元素中 Y 的最高价含氧酸的酸性最强 D. 同周期元素中 X 的金属性最强 9.(暑假作业 P40 )下列实验现象或操作不能达到相应实验目的的是 ( ) 10.海洋中有丰富的资源,如图为海水资源利用的部分过程。 已知粗盐中含有SO-、Ca2+、Mg2+ 等杂质,下列有关说法正确的是 ( ) A. 过程①中依次加入的试剂是NaOH 溶液、 Na2 CO3 溶液、 BaCl2 溶液,盐酸 B. 过程②中蒸馏法是最具有发展前景的海水淡化方法 C. 过程③中包含制取MgCl2 溶液, 电解MgCl2 溶液两个步骤 D. 过程④中SO2 水溶液吸收Br2 后,溶液的pH 减小 11.有 a 、b 、c 、d 四个金属电极,有关的实验装置及部分实验现象如下: 实验装置 部分实验现象 a 极质量减小;b 极质量增加 b 极有气体产生;c 极无 变化 d 极溶解;c 极有气 体产生 电流从 a 极流向 d 极 由此可判断这四种金属的活动性顺序是 ( ) A . a>b>c>d B . b>c>d>a C . d>a>b>c D . a>b>d>c 12.(暑假作业 P24)某科研机构研发的 NO-空气燃料电 池的工作原理如图所示,下列叙述正确的是 ( ) A.a 电极为电池负极 B. 电池工作时 H+透过质子交换膜从右向左移动 C.b 电极的电极反应:NO-3e-+2H2O=4H++NO3- D. 当外电路中通过 0.2mol 电子时,a 电极处消耗 O21.12 L 13.(暑假作业 P50 )在 25℃和 101kPa 下,1gH2 燃烧生成液态水放出 142.9kJ 的热量,则下列属于 H2 的燃 烧热的热化学方程式的是 ( ) A.2H2(g)+O2(g)=2H2O(1) △H=-142.9 kJ/mol B.H2(g)+1/2O2(g)=H2O(g) △H=+285.8 kJ/mol C.2H2(g)+O2(g)=2H2O(1) △H=-571.6 ... ...
~~ 已预览到文档结尾了 ~~