
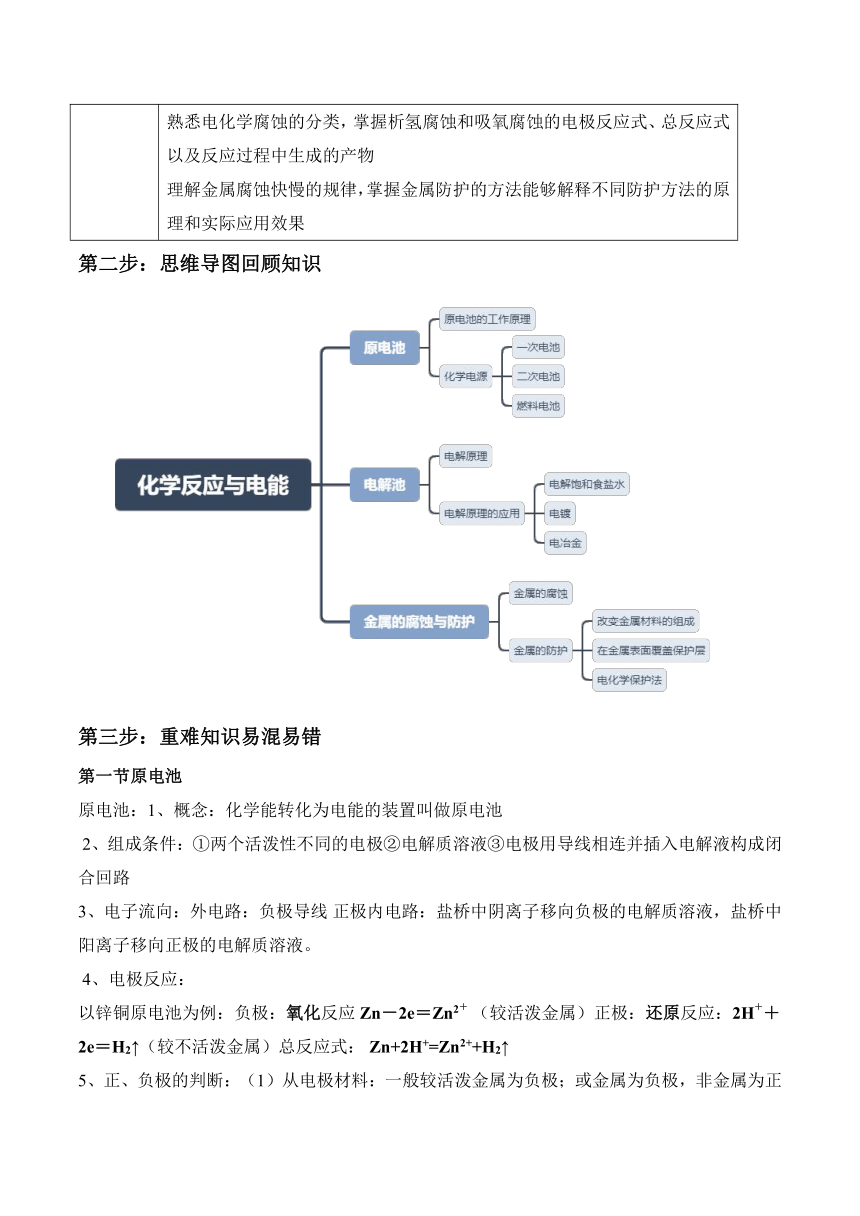
化学反应与电能 考点清单 第一步:学习目标整合 1 理解原电池的概念,能够根据原电池的组成条件判断给定装置是否为原电池,掌握原电池将化学能转化为电能的本质。 熟悉原电池的工作原理,包括电极材料的选择、电极反应、电子流向以及内电路中离子的移动方向,能够正确书写原电池的电极反应式和总反应式。 学会判断原电池的正负极,掌握从电极材料、电子流动方向、电流方向、电解质溶液内离子移动方向、实验现象等多个角度判断正负极的方法。 了解原电池原理在日常生活和工业生产中的应用,如化学电源的工作原理及特点,能够根据给定的电池反应判断电池类型、书写电极反应式,并理解电池的优缺点和应用场景。 2 掌握常见一次电池的组成、工作原理、电极反应式和应用特点,了解其在不同领域的使用情况。 熟悉二次电池的放电和充电过程,能够正确书写其电极反应式 理解燃料电池的工作原理,掌握不同介质下燃料电池电极反应式的书写方法 3 理解电解池的概念,掌握电解池将电能转化为化学能的过程,明确电解的条件和实质。 熟悉电解池的工作原理,包括电极名称、电子流向以及离子放电顺序,能够根据给定的电解质溶液和电极材料正确书写电解池的电极反应式和总反应式。 掌握电解规律,能够根据电解对象、电解质浓度变化、溶液 pH 变化以及电解后溶液复原的方法对电解反应进行分类,并能分析不同类型电解反应的特点和应用。 了解电解原理在工业生产中的应用,如电解饱和食盐水制备烧碱、氯气和氢气,电镀,电冶金,能够解释这些工业过程的原理和实际操作要点。 4 理解金属腐蚀的本质,掌握金属腐蚀的分类,能够区分化学腐蚀和电化学腐蚀的条件、现象和本质。 熟悉电化学腐蚀的分类,掌握析氢腐蚀和吸氧腐蚀的电极反应式、总反应式以及反应过程中生成的产物 理解金属腐蚀快慢的规律,掌握金属防护的方法能够解释不同防护方法的原理和实际应用效果 第二步:思维导图回顾知识 第三步:重难知识易混易错 第一节原电池 原电池:1、概念:化学能转化为电能的装置叫做原电池 2、组成条件:①两个活泼性不同的电极②电解质溶液③电极用导线相连并插入电解液构成闭合回路 3、电子流向:外电路:负极导线 正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。 4、电极反应: 以锌铜原电池为例:负极:氧化反应Zn-2e=Zn2+ (较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式: Zn+2H+=Zn2++H2↑ 5、正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极 (4)根据电解质溶液内离子的移动方向 阳离子流向正极,阴离子流向负极(5)根据实验现象①溶解的一极为负极② 增重或有气泡一极为正极 第二节 化学电池 1、电池的分类:化学电池、太阳能电池、原子能电池 2、化学电池:借助于化学能直接转变为电能的装置 3、化学电池的分类:一次电池、二次电池、燃料电池 一、常见一次电池:碱性锌锰电池、锌银电池、锂电池等 二、二次电池:1、二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。 2、电极反应:铅蓄电池 3、目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池 三、燃料电池 1、燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池 2、电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。负极发生氧化反应,正极发生还原反应,不过要注意一般电解质溶液要参与电极反应。以氢氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中 ... ...
~~ 已预览到文档结尾了 ~~