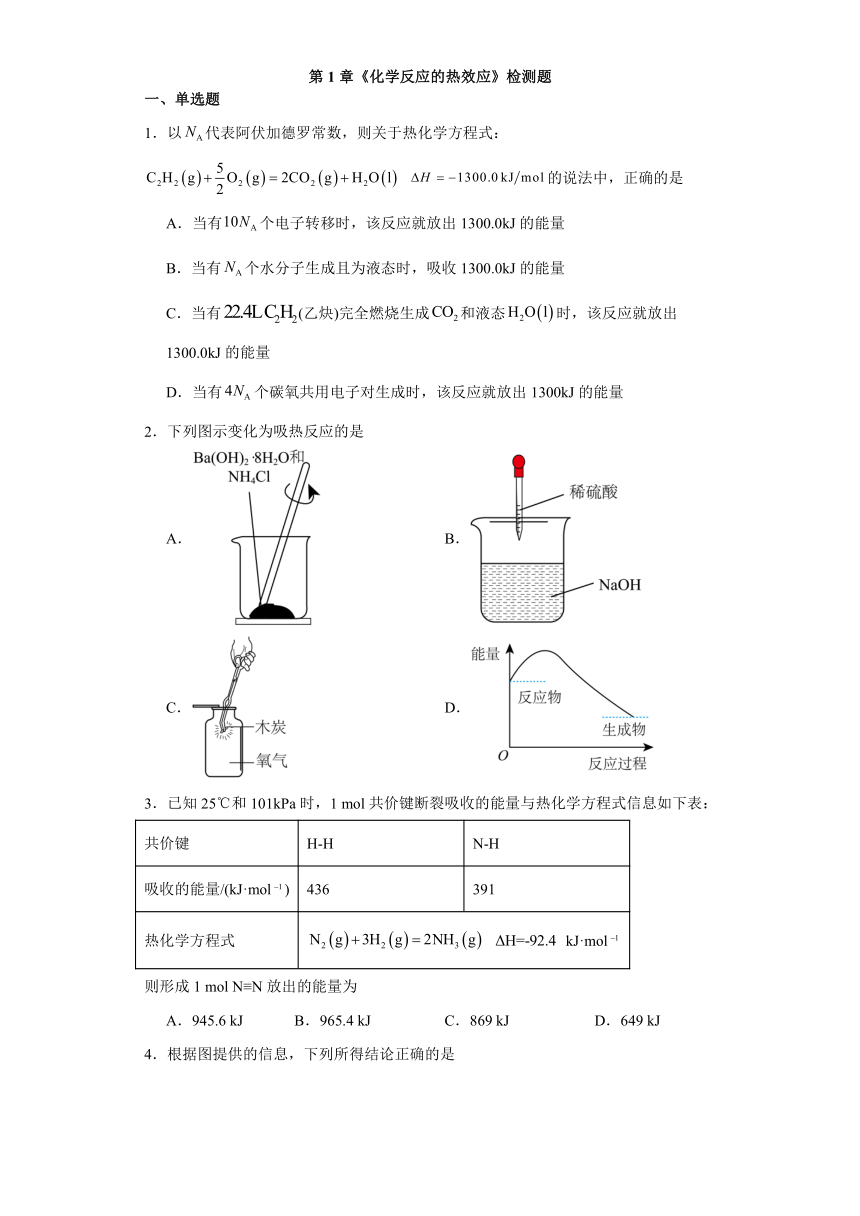
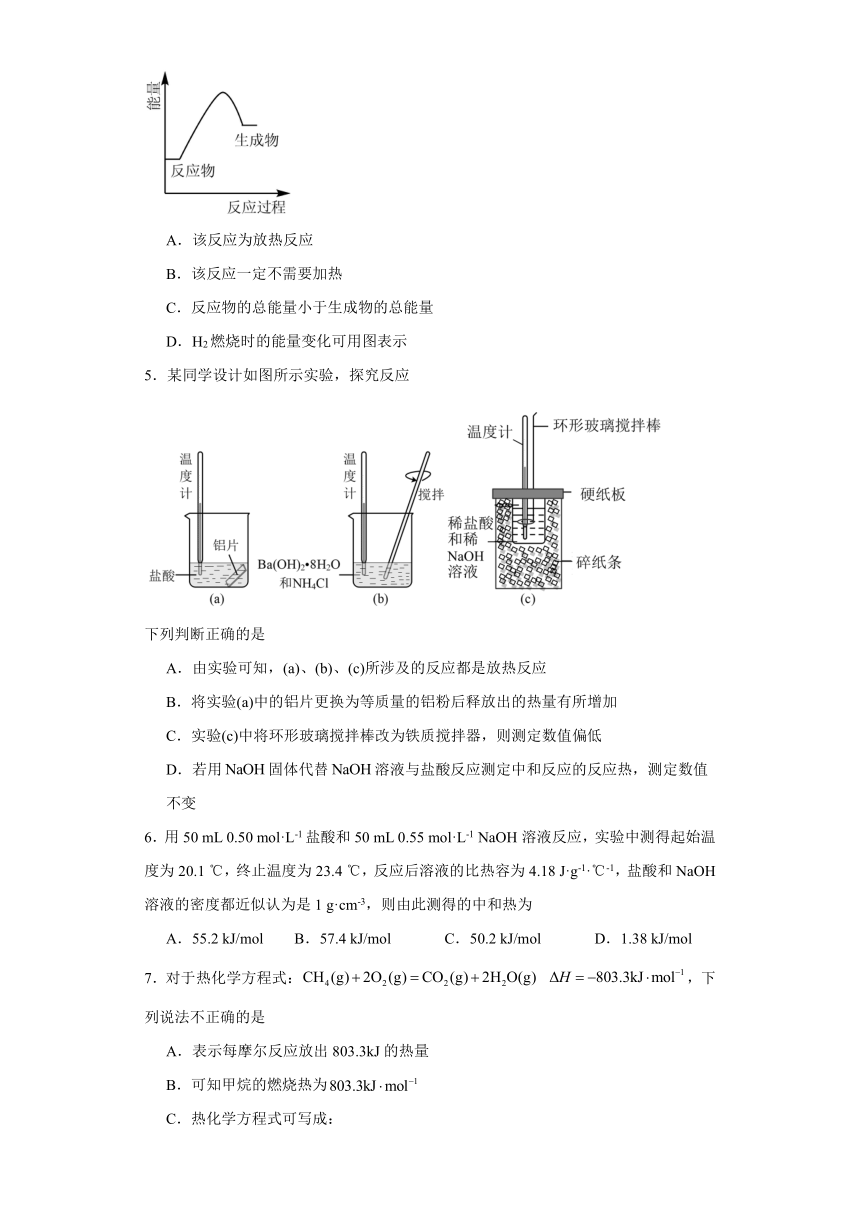
第1章《化学反应的热效应》检测题 一、单选题 1.以代表阿伏加德罗常数,则关于热化学方程式: 的说法中,正确的是 A.当有个电子转移时,该反应就放出1300.0kJ的能量 B.当有个水分子生成且为液态时,吸收1300.0kJ的能量 C.当有(乙炔)完全燃烧生成和液态时,该反应就放出1300.0kJ的能量 D.当有个碳氧共用电子对生成时,该反应就放出1300kJ的能量 2.下列图示变化为吸热反应的是 A. B. C. D. 3.已知25℃和101kPa时,1 mol共价键断裂吸收的能量与热化学方程式信息如下表: 共价键 H-H N-H 吸收的能量/(kJ·mol) 436 391 热化学方程式 kJ·mol 则形成1 mol N≡N放出的能量为 A.945.6 kJ B.965.4 kJ C.869 kJ D.649 kJ 4.根据图提供的信息,下列所得结论正确的是 A.该反应为放热反应 B.该反应一定不需要加热 C.反应物的总能量小于生成物的总能量 D.H2燃烧时的能量变化可用图表示 5.某同学设计如图所示实验,探究反应 下列判断正确的是 A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器,则测定数值偏低 D.若用固体代替溶液与盐酸反应测定中和反应的反应热,测定数值不变 6.用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则由此测得的中和热为 A.55.2 kJ/mol B.57.4 kJ/mol C.50.2 kJ/mol D.1.38 kJ/mol 7.对于热化学方程式:,下列说法不正确的是 A.表示每摩尔反应放出803.3kJ的热量 B.可知甲烷的燃烧热为 C.热化学方程式可写成: D.表明化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因 8.用如图所示的装置进行中和反应反应热的测定。下列说法正确的是 A.如图条件下,实验过程中没有任何热量损失 B.为了使反应充分进行,药品可以分多次加入 C.完成一次中和反应反应热平行样的测定,温度计需要使用2次 D.测量NaOH与不同种类的酸中和反应的反应热,数值可能不同 9.C、CO、CH3OH和C2H5OH是常用的燃料,1mol上述物质分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ,283.0kJ,725.76kJ和1366.8kJ。相同质量的这4种燃料完全燃烧,放出的热量最多的是 A.C B.CO C.CH3OH D.C2H5OH 10.已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1 H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为 A.-332 B.-118 C.+350 D.+130 11.某反应由两步反应AB,BC构成,它的反应能量曲线如图。下列有关叙述正确的是 A.三种化合物中B最稳定 B.反应CB的焓变为E4-E3 C.加入催化剂会改变反应的焓变 D.整个反应的△H =(E2+E4)-(E3+E1) 12.在测定中和反应反应热的实验中,下列说法正确的是 A.测量酸溶液的温度后,未冲洗温度计就测碱溶液的温度,会使求得的中和热的数值偏大 B.0.1mol/L盐酸与某强碱稀溶液中和放出的热量随反应物的用量改变而改变,但中和反应反应热不变 C.分多次把NaOH溶液倒入盛有稀盐酸的量热计的内筒中 D.玻璃搅拌器沿内筒壁顺时针移动,使酸碱溶液混合 13.已知:反应 。现分别取50mL 0.50mol/L醋酸溶液与50mL 0.55mo/L NaOH溶液进行反应,用如图实验装置测定该反应的反应热,下列说法错误的是 A.小烧杯和大烧杯的杯口应相平 B.使用环形玻璃搅拌棒是为了使反应更充分 C.为了让反应充分进行,NaOH分三次倒入 D.该实验测得的反应热 14.有关键能数据如表: 化学键 Si﹣O O=O Si﹣Si 键能kJ·mol﹣1 X 500 ... ...
~~ 已预览到文档结尾了 ~~