
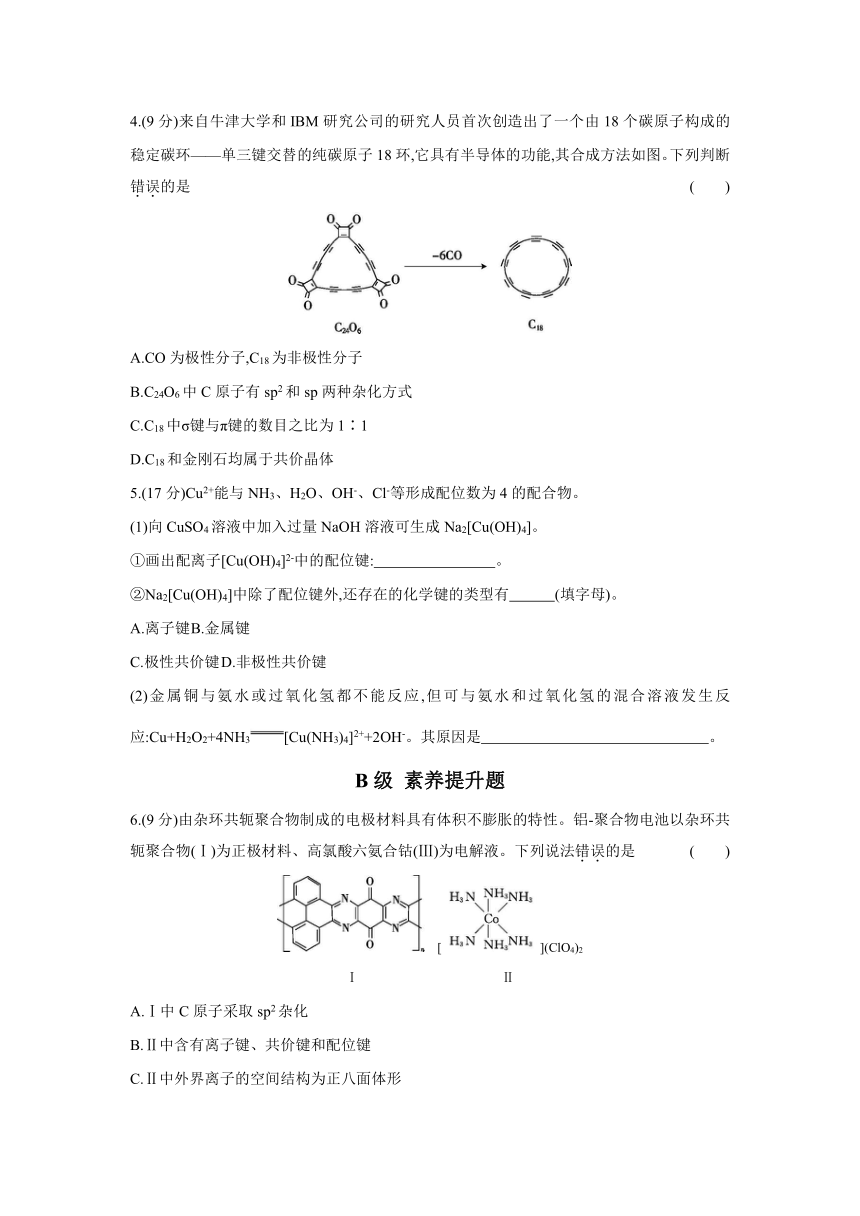
3.6 配合物与超分子 (30分钟 100分) 班级 姓名 成绩 【课时目标】 基础 达标 1.能判断配位键及理解配位键成因 2.判断配位化合物,举例说明有关配位化合物的相关概念 3.了解超分子的结构特点与性质 素养 突破 1.能用配位键理论分析配合物中配位键数目、配位数 2.解释配位化合物在生产、生活中的运用 【课时必刷】 A级 基础训练题 1.(9分)我国科学家制得了SiO2超分子纳米管。下列叙述正确的是 ( ) A.SiO2晶体与干冰的晶体结构相似 B.SiO2耐腐蚀,不与任何酸反应 C.该SiO2超分子纳米管具有分子识别和自组装特征 D.光纤的主要成分是SiO2,具有导电性 2.(9分)某锰的化合物的结构简式如图,其分子不含有的作用力是 ( ) A.离子键 B.氢键 C.配位键 D.非极性键 3.(9分)1 mol下列配离子所含配位键数目最少的是 ( ) A.[Cu(H2O)4]2+ B.[B(OH)4]- C.[Fe(SCN)6]3- D.Fe(CO)5 4.(9分)来自牛津大学和IBM研究公司的研究人员首次创造出了一个由18个碳原子构成的稳定碳环———单三键交替的纯碳原子18环,它具有半导体的功能,其合成方法如图。下列判断错误的是 ( ) A.CO为极性分子,C18为非极性分子 B.C24O6中C原子有sp2和sp两种杂化方式 C.C18中σ键与π键的数目之比为1∶1 D.C18和金刚石均属于共价晶体 5.(17分)Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。 (1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。 ①画出配离子[Cu(OH)4]2-中的配位键: 。 ②Na2[Cu(OH)4]中除了配位键外,还存在的化学键的类型有 (填字母)。 A.离子键 B.金属键 C.极性共价键 D.非极性共价键 (2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3[Cu(NH3)4]2++2OH-。其原因是 。 B级 素养提升题 6.(9分)由杂环共轭聚合物制成的电极材料具有体积不膨胀的特性。铝-聚合物电池以杂环共轭聚合物(Ⅰ)为正极材料、高氯酸六氨合钴(Ⅲ)为电解液。下列说法错误的是 ( ) [](ClO4)2 Ⅰ Ⅱ A.Ⅰ中C原子采取sp2杂化 B.Ⅱ中含有离子键、共价键和配位键 C.Ⅱ中外界离子的空间结构为正八面体形 D.Ⅱ中内界离子的中心原子的配位数为6 7.(9分)把CoCl2溶于水后加氨水先生成Co(OH)2沉淀,后沉淀溶解,再加氨水,生成了[Co(NH3)6]Cl2,此时向溶液中通入空气,得到的一种产物的组成可以用CoCl3·5NH3表示,Co的配位数是6,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,析出氯化银沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。下列说法错误的是 ( ) A.产物CoCl3·5NH3中的配位体为氨分子和氯离子 B.通入空气后得到的溶液中含有[Co(NH3)5Cl]2+ C.[Co(NH3)6]Cl2的中心离子的价电子排布式为3d54s2 D.[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键 8.(20分)有色金属资源是全球各国工业发展的重要保证。钛、钴、锰等有色金属及化合物在磁性材料、新型电池等许多领域都有着广泛的应用。请回答下列问题: (1)Mn(BH4)2是一种储氢材料,B中配位键的数目为 ,B的空间结构是 。 (2)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。 ①TiCl4(H2NCH2CH2NH2)中提供电子对形成配位键的原子是 。 ②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物的稳定性较差的是 (填“Mg2+”或“Cu2+”)。 (3)钴氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。 ①用过量KCN处理含Co2+的盐溶液,可生成紫色的[Co(CN)6]4-。[Co(CN)6]4-中所含σ键与π键的数目之比为 。 ②Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5 ... ...
~~ 已预览到文档结尾了 ~~