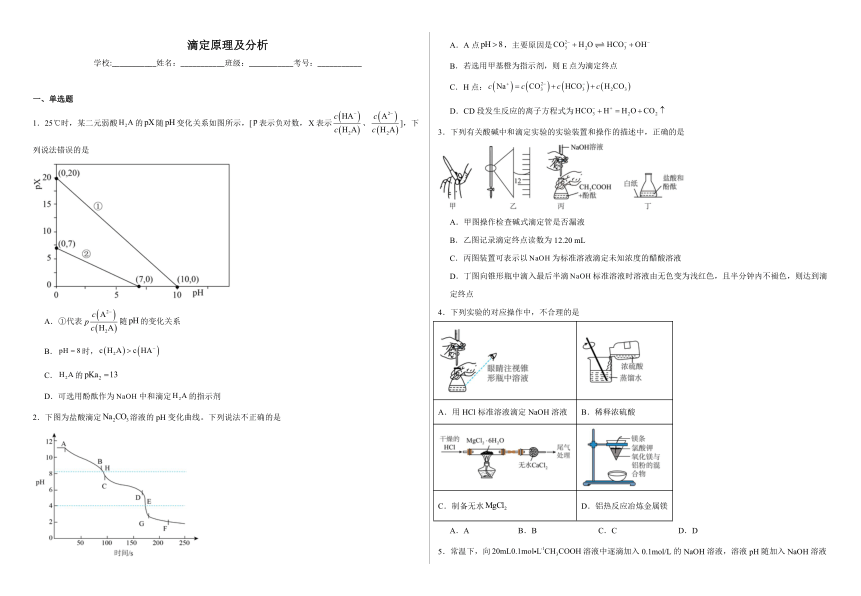
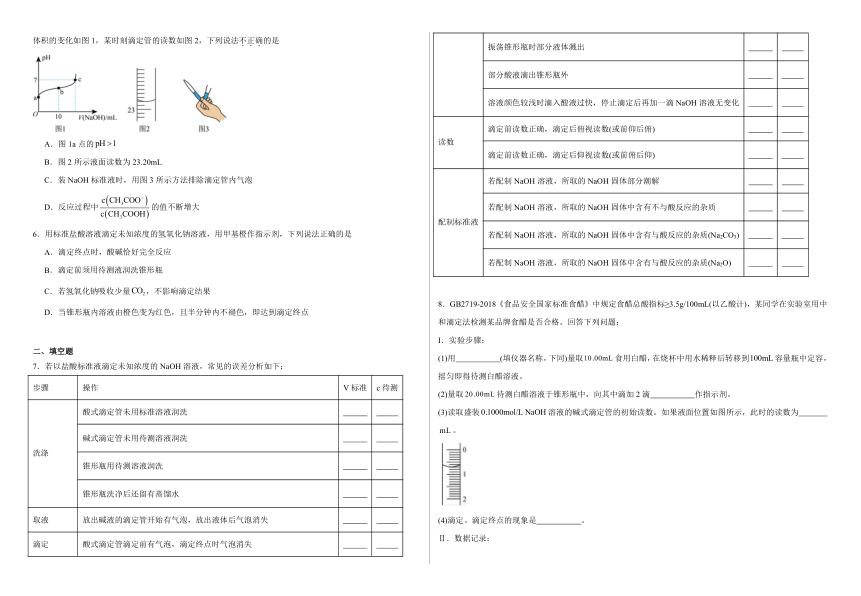
滴定原理及分析 学校:_____姓名:_____班级:_____考号:_____ 一、单选题 1.25℃时,某二元弱酸的随变化关系如图所示,[表示负对数,表示、],下列说法错误的是 A.①代表随的变化关系 B.时, C.的 D.可选用酚酞作为中和滴定的指示剂 2.下图为盐酸滴定溶液的pH变化曲线。下列说法不正确的是 A.A点,主要原因是 B.若选用甲基橙为指示剂,则E点为滴定终点 C.H点: D.CD段发生反应的离子方程式为 3.下列有关酸碱中和滴定实验的实验装置和操作的描述中,正确的是 A.甲图操作检查碱式滴定管是否漏液 B.乙图记录滴定终点读数为12.20 mL C.丙图装置可表示以为标准溶液滴定未知浓度的醋酸溶液 D.丁图向锥形瓶中滴入最后半滴标准溶液时溶液由无色变为浅红色,且半分钟内不褪色,则达到滴定终点 4.下列实验的对应操作中,不合理的是 A.用HCl标准溶液滴定NaOH溶液 B.稀释浓硫酸 C.制备无水 D.铝热反应冶炼金属镁 A.A B.B C.C D.D 5.常温下,向溶液中逐滴加入0.1mol/L的NaOH溶液,溶液pH随加入NaOH溶液体积的变化如图1,某时刻滴定管的读数如图2,下列说法不正确的是 A.图1a点的 B.图2所示液面读数为23.20mL C.装NaOH标准液时,用图3所示方法排除滴定管内气泡 D.反应过程中的值不断增大 6.用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,用甲基橙作指示剂,下列说法正确的是 A.滴定终点时,酸碱恰好完全反应 B.滴定前须用待测液润洗锥形瓶 C.若氢氧化钠吸收少量,不影响滴定结果 D.当锥形瓶内溶液由橙色变为红色,且半分钟内不褪色,即达到滴定终点 二、填空题 7.若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下: 步骤 操作 V标准 c待测 洗涤 酸式滴定管未用标准溶液润洗 碱式滴定管未用待测溶液润洗 锥形瓶用待测溶液润洗 锥形瓶洗净后还留有蒸馏水 取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失 滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失 振荡锥形瓶时部分液体溅出 部分酸液滴出锥形瓶外 溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化 读数 滴定前读数正确,滴定后俯视读数(或前仰后俯) 滴定前读数正确,滴定后仰视读数(或前俯后仰) 配制标准液 若配制NaOH溶液,所取的NaOH固体部分潮解 若配制NaOH溶液,所取的NaOH固体中含有不与酸反应的杂质 若配制NaOH溶液,所取的NaOH固体中含有与酸反应的杂质(Na2CO3) 若配制NaOH溶液,所取的NaOH固体中含有与酸反应的杂质(Na2O) 8.GB2719-2018《食品安全国家标准食醋》中规定食醋总酸指标≥3.5g/100mL(以乙酸计),某同学在实验室用中和滴定法检测某品牌食醋是否合格。回答下列问题: I.实验步骤: (1)用 (填仪器名称,下同)量取食用白醋,在烧杯中用水稀释后转移到容量瓶中定容,摇匀即得待测白醋溶液。 (2)量取待测白醋溶液于锥形瓶中,向其中滴加2滴 作指示剂。 (3)读取盛装溶液的碱式滴定管的初始读数。如果液面位置如图所示,此时的读数为 。 (4)滴定。滴定终点的现象是 。 Ⅱ.数据记录: 滴定次数实验数据/ 1 2 3 4 V(样品) 20.00 20.00 20.00 20.00 (消耗) 15.95 15.00 15.05 14.95 Ⅲ.数据处理: (5)该白醋的总酸度为 ,该品牌白醋 (填“合格”或“不合格”)。 IV.反思与总结: (6)实验过程中该同学出现了以下操作,其中可能导致结果偏大的是 (填字母)。 A.酸式滴定管没有进行润洗 B.锥形瓶用待测白醋润洗 C.滴定开始时滴定管中有气泡,结束时无气泡 D.指示剂变色立即停止滴定 E.滴定开始时俯视读数,结束时仰视读数 9.氢氧化钠溶液是中学化学实验中的常用试剂。回答下列问题: Ⅰ.配制一定物质的量浓度的氢氧化钠溶液 (1)下列操作错误的是 (填字母序号),该错误操作会导致所配溶液浓度 (填“ ... ...
~~ 已预览到文档结尾了 ~~