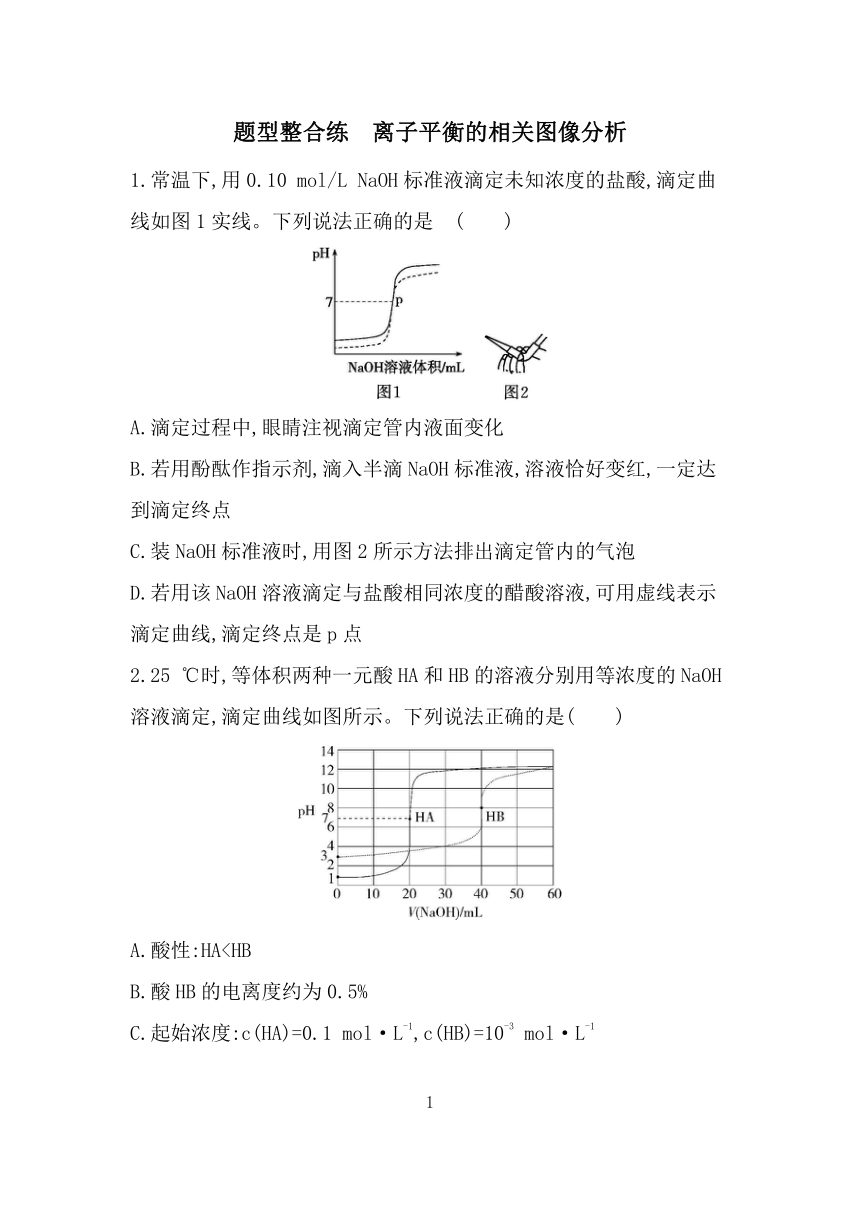
题型整合练 离子平衡的相关图像分析 1.常温下,用0.10 mol/L NaOH标准液滴定未知浓度的盐酸,滴定曲线如图1实线。下列说法正确的是 ( ) A.滴定过程中,眼睛注视滴定管内液面变化 B.若用酚酞作指示剂,滴入半滴NaOH标准液,溶液恰好变红,一定达到滴定终点 C.装NaOH标准液时,用图2所示方法排出滴定管内的气泡 D.若用该NaOH溶液滴定与盐酸相同浓度的醋酸溶液,可用虚线表示滴定曲线,滴定终点是p点 2.25 ℃时,等体积两种一元酸HA和HB的溶液分别用等浓度的NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是( ) A.酸性:HAc点 C.a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同 D.从c点到d点,溶液中不变(HA、A-分别代表相应的酸和酸根离子) 4.草酸H2C2O4是二元弱酸。向100 mL 0.40 mol·L-1 H2C2O4溶液中加入1.0 mol·L-1KOH溶液调节pH,加水控制溶液体积为200 mL。测得溶液中微粒的δ(x)随pH变化如图所示,其中δ(x)=,x代表微粒H2C2O4、HC2或C2。常温时,下列叙述正确的是( ) A.曲线Ⅱ是C2的变化曲线 B.曲线Ⅰ,随pH增大,H2O的电离程度减小 C.pH=3时,溶液中c(H2C2O4)+c(HC2)+c(C2)=0.40 mol·L-1 D.pH=4时,=103 5.已知常温下,Ka1(H2S)=9.1×10-8, Ka2(H2S)=1.1×10-12。某二元酸H2R易溶于水,将NaOH溶液滴入等物质的量浓度H2R溶液中,H2R、HR-、R2-的物质的量分数随pH的变化如图所示。下列说法错误的是( ) A.常温下,H2R HR-+H+的电离平衡常数Ka1=10-6.37 B.常温下,在pH=10.25时,c(R2-)=c(HR-)>c(OH-)>c(H+) C.当V(NaOH)∶V(H2R)=3∶2时,c(R2-)+c(OH-)=3c(H2R)+c(HR-)+c(H+) D.向Na2R溶液中加入足量H2S溶液,发生反应:R2-+H2S HS-+HR- 6.铬酸钠(Na2CrO4)水溶液中存在如下平衡:2H++2Cr 2HCr Cr2+H2O,25 ℃时,在1.00 mol·L-1铬酸钠溶液中,各种含铬离子的分布分数与pH的关系如图所示。 下列说法错误的是( ) A.Na2CrO4溶液中,Cr发生水解而使溶液呈碱性 B.铬酸(H2CrO4)的二级电离常数Ka2=10-6.4 C.要得到纯度较高的Na2CrO4溶液,应控制pH>9 D.pH=6时,Na2CrO4溶液中存在:c(Na+)=2c(Cr)+2c(HCr)+2c(Cr2) 7.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lgc(Mn+),横坐标p(S2-)表示-lgc(S2-),下列说法不正确的是( ) A.该温度下,Ag2S的Ksp=1.0×10-50 B.该温度下,溶解度的大小顺序为NiS>SnS C.SnS和NiS的饱和溶液中=104 D.向浓度均为0.1 mol·L-1的Ag+、Ni2+、Sn2+混合溶液中逐滴加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS 8.常温下,AgCl(白色)与Ag2CrO4(砖红色)的沉淀溶解平衡曲线如图所示,pAg=-lgc(Ag+),pX= -lgc(X),X=Cl-或Cr。下列说法错误的是( ) A.Ksp(Ag2CrO4)=10-11.4 B.区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在Ag2CrO4沉淀 C.向Cl-、Cr均为0.1 mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D.反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+Cr(aq)的平衡常数K为108.2 答案与分层梯度式解析 题型整合练 离子平衡的相关图像分析 1.C 滴定过程中,眼睛注视锥形瓶中溶液颜色变化,A项错误;若用酚酞作指示剂,滴入最后半滴NaOH标准液,溶液恰好变红,且半分钟内不变色,则达到滴定终点,B项错误;NaOH标准液使用碱式滴定管盛装,可用图2所示方法排出滴定管内的气泡,C项正确;相同浓度的盐酸和醋酸溶液,因为盐酸是强酸,所以电离出的氢离子比醋酸多,pH小于醋酸溶液,D ... ...
~~ 已预览到文档结尾了 ~~